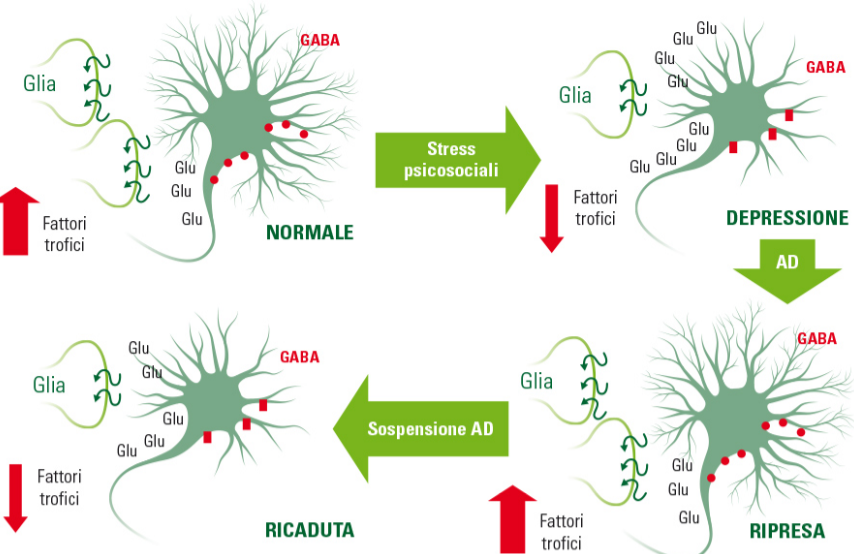
Grazie anche alle nuove tecniche di brain imaging, è stato possibile formulare diverse ipotesi sull’eziologia della depressione BASI NEUROBIOLOGICHE DELLA DEPRESSIONE Lo studio delle basi neurobiologiche della depressione inizia negli anni cinquanta quando nei laboratori del National Institute of Health di Bethesda, Bernard Brodie osservò che la reserpina, una molecola ad azione antiipertensiva ed antipsicotica capace di indurre una sindrome depressiva nell’uomo, produceva nel ratto la quasi totale deplezione di serotonina cerebrale. Successivamente Arvid Carlson dimostrò che la reserpina depletava anche i livelli cerebrali di Noradrenalina e Dopamina, suggerendo, per la prima volta, che queste monoamine potessero essere coinvolte nel controllo della sfera affettiva e che la riduzione dei loro livelli cerebrali potesse essere la causa principale scatenante la patologia depressiva. Questi affascinanti e straordinari risultati motivarono le industrie farmaceutiche ad attivare linee di ricerca al fine di sviluppare molecole capaci di aumentare i livelli di monoamine, presumibilmente ridotti in alcune aree del cervello dei soggetti depressi. L’ipotesi monoaminergica della depressione costituì una cruciale e ancora oggi valida base biologica per la farmacoterapia della patologia depressiva quando fu dimostrato che tutti i farmaci antidepressivi inducevano in poche ore un marcato aumento dei livelli cerebrali di serotonina e/o noradrenalina. A distanza di oltre 60 anni la terapia farmacologica di questa patologia utilizza ancora molecole capaci di aumentare i livelli sinaptici di serotonina e/o noradrenalina. Lo sviluppo di queste molecole non solo ha permesso di ottenere farmaci efficaci e con sempre minori effetti collaterali, ma ha dato anche un contributo fondamentale alla comprensione dei meccanismi molecolari e cellulari coinvolti nell’eziopatogenesi dei disturbi della sfera affettiva, emozionale e cognitiva. L’ipotesi monoaminergica della depressione (l’antidepressivo in poche ore aumenta i livelli di monoamine nelle sinapsi) è stata per oltre 40 anni in apparente contrasto con l’evidenza clinica che dimostra come il miglioramento dei sintomi non avviene prima di 4-6 settimane dall’inizio del trattamento. Questo paradosso ha trovato solo di recente una spiegazione convincente sia dalla ricerca di base che clinica con la dimostrazione che un trattamento di 4-6 settimane con antidepressivi, utile ad ottenere un significativo miglioramento dei sintomi era anche necessario per stimolare i meccanismi molecolari che modulano la funzione di specifici geni coinvolti nella espressione e sintesi di differenti fattori trofici. Infatti, attraverso questo meccanismo i farmaci antidepressivi sono capaci nel tempo (settimane/mesi) di migliorare la alterata funzione dei neuroni, rendendoli meno sensibili agli eventi stressanti attraverso un parziale recupero del loro trofismo con il conseguente parziale o totale ripristino, nell’arco di mesi/anni, dei volumi di alcune importanti aree cerebrali coinvolte nella modulazione della sfera affettiva, emozionale e cognitiva. Pertanto, alla fine degli anni novanta la scoperta che farmaci sintetizzati e sviluppati per aumentare in tempi rapidi (ore) le concentrazioni sinaptiche di monoamine erano anche in grado di modificare in tempi più lunghi (settimane) la funzione di specifici geni capaci di esprimere molecole ad azione neurotrofica ha suggerito di affiancare alla ipotesi monoaminergica l’ipotesi neurotrofica. DEPRESSIONE E PLASTICITÀ NEURONALE La depressione è una patologia cronica, progressiva e ricorrente le cui basi eziopatogenetiche sono associate non solo ad una disfunzione della trasmissione monoaminergica ma anche ad una progressiva perdita del trofismo neuronale con conseguente riduzione delle proprietà plastiche e quindi l’incapacità di sottopopolazioni neuronali di specifiche aree cerebrali, coinvolte nel controllo della sfera emozionale, affettiva, fisica e delle funzioni cognitive, a sapersi adattare agli stimoli ambientali negativi. Alterazioni nei livelli dei neurotrasmettitori, nell’attività dei sistemi di trasduzione del segnale e nell’espressione di specifici geni sono alla base del fenomeno noto come plasticità cellulare, cioè la capacità dei neuroni di sapersi adattare sia a livello morfologico che funzionale a stimoli ambientali, endocrini e farmacologici, e agli stessi insulti stressanti. Studi sperimentali hanno infatti dimostrato che le proprietà plastiche dei neuroni sono associate a modificazioni nella morfologia cellulare che possono determinare un aumento o una diminuzione nella formazione di sinapsi e spine dendritiche, così come in un’estensione o ritrazione di dendriti. Le modificazioni della plasticità neuronale si associano a diverse modalità di apprendimento e memorizzazione e sono a loro volta stimolate dall’ambiente arricchito (ovvero da una condizione ottimale che fornisce all’individuo una maggiore quantità e varietà di stimoli positivi), dall’esercizio fisico e dal trattamento a lungo termine con farmaci psicotropi, mentre sono inibite dallo stress psicosociale e dallo stato di depressione, ansia, psicosi. Nel loro insieme questi dati hanno più di recente indirizzato la ricerca a capire i complessi meccanismi di regolazione del trofismo e plasticità neuronale dando origine a quella che viene definita come ipotesi neurotrofica della depressione. IPOTESI NEUROTROFICA L’ipotesi neurotrofica della depressione ha origine tra la fine degli anni novanta e l’inizio del nuovo secolo quando la ricerca sperimentale prima e la ricerca clinica subito dopo dimostrano che i neuroni cerebrali in seguito a eventi stressanti di varia natura e di lunga durata vanno incontro ad una perdita di trofismo. Le ricerche sperimentali hanno dimostrato in modo inequivocabile che i neuroni del cervello di ratti sottoposti a stress cronico perdono trofismo e mostrano una riduzione sia della ramificazione dendritica che della densità delle spine dendritiche. Parallelamente a queste evidenze la ricerca clinica ha dimostrato che il volume di alcune aree cerebrali (ippocampo, corteccia prefrontale, nucleo accubens) di soggetti con depressione grave, non trattata farmacologicamente o che hanno subito gravi traumi psicologici è significativamente ridotto rispetto ai soggetti sani. La scoperta sia a livello sperimentale che clinico che il trattamento con i farmaci antidepressivi reverte in modo significativo l’ipotrofismo neuronale indotto a livello sperimentale dallo stress cronico così come la riduzione di volume di alcune aree cerebrali presente nella patologia depressiva, ha suggerito che questi farmaci nati per ripristinare i ridotti livelli di serotonina e/o noradrenalina hanno anche la capacità di ripristinare almeno in parte l’ipotrofismo neuronale e le conseguenti alterazioni funzionali della sfera affettiva, emozionale e cognitiva ad esso associate. L’evidenza che tutti i farmaci antidepressivi hanno la capacità di attivare, anche se in modo totalmente aspecifico, differenti geni capaci di esprimere sia fattori trofici che molecole del sistema immunitario capaci di modulare i meccanismi regolatori del trofismo neuronale, ha portato nuove conoscenze sui meccanismi eziopatogenetici della patologia depressiva. In particolare, questi studi hanno evidenziato che i fattori trofici di origine neuronale (Brain-derived neurotrophic factor o BDNF) e gliale (Glial cell-derived neurotrophic factor o GDNF) svolgono un ruolo cruciale nel mediare gli effetti dei farmaci antidepressivi sul trofismo neuronale. LA NEUROGENESI L’evidenza che il BDNF e altre molecole trofiche svolgono un ruolo cruciale nel meccanismo di differenziazione e proliferazione di nuove cellule, fenomeno che si verifica in condizioni fisiologiche nel cervello umano dall’infanzia, all’adolescenza fino alla vecchiaia e risulta essere cruciale nel controllo dei meccanismi adattivi agli eventi stressanti, agli insulti patologici, ai trattamenti farmacologici, suggerisce che la neurogenesi è un fenomeno strettamente connesso all’ipotesi neurotrofica. Infatti, l’integrità funzionale delle vie metaboliche che portano alla sintesi di fattori trofici e alla proliferazione di nuove cellule è considerata cruciale per garantire alla cellula adulta come a quella neoformata le risposte adattative migliori e più immediate. Al contrario, la ridotta espressione genica dei fattori trofici e del processo di neurogenesi dovute a stress prolungati o a particolari fattori genetici (polimorfismi) si pensa possa avere un ruolo cruciale nell’aumentare la soglia di vulnerabilità ai disturbi del tono dell’umore e/o nel ridurre la resilienza nei soggetti depressi. La neurogenesi (differenziamento e proliferazione di nuovi neuroni) è un processo biologico ben documentato nel cervello dei mammiferi, dai roditori fino ai primati, uomo incluso. Questo fenomeno è molto intenso nell’età infantile e adolescenziale, si riduce significativamente nel cervello adulto ed è ancora presente nel cervello dell’anziano. Importanti e recentissimi studi hanno dimostrato che questo affascinante meccanismo di rinnovamento del cervello attraverso l’espressione di nuovi neuroni viene marcatamente potenziato da condizioni ambientali favorevoli quali l’ambiente arricchito, l’apprendimento, una dieta bilanciata, l’attività fisica e soprattutto da un adeguato numero di ore di sonno ristoratore. Non a caso la melatonina potenzia in modo significativo il differenziamento delle cellule staminali e la proliferazione dei neuroni, mentre la deprivazione di sonno, così come altri stimoli stressanti, una dieta inadeguata, la vita sedentaria e la mancanza di interazioni sociali e motivazioni inibiscono questo fenomeno. È rilevante sottolineare che l’alcool e molte sostanze d’abuso inibiscono il differenziamento delle cellule staminali e la proliferazione dei neuroni e cellule gliali riducendo significativamente il processo di neurogenesi soprattutto nel cervello dei bambini e degli adolescenti. Al contrario, tutti i farmaci antidepressivi potenziano la neurogenesi favorendo il differenziamento e la proliferazione dei neuroni. È interessante sottolineare che la neurogenesi sembra essere associata alla capacità del cervello dei mammiferi, uomo incluso, a memorizzare i ricordi recenti, fenomeno che si riduce significativamente nel cervello che invecchia nel quale il processo di neurogenesi è notevolmente ridotto. REMISSIONE E RECIDIVA: ASPETTI NEUROBIOLOGICI Uno dei più importanti problemi della neurobiologia sperimentale e clinica dei disturbi affettivi è capire quanto un disturbo depressivo sia in grado, se non trattato in modo tempestivo e adeguato (dosaggio appropriato e protratto nel tempo), di alterare in modo quasi irreversibile l’omeostasi dei neuroni, in particolare nelle aree cerebrali quali l’ippocampo, l’amigdala e la corteccia del cingolo la cui morfologia e funzione risultano essere alterate da questa patologia. Nei soggetti depressi, nei quali il trattamento non viene protratto per un tempo sufficiente, il numero di recidive nei mesi successivi alla sospensione della terapia è sempre marcatamente superiore a quello dei pazienti trattati per almeno 2 anni. Inoltre, nei pazienti con ripetute recidive il volume dell’ippocampo risulta significativamente ridotto rispetto ai valori ottenuti negli stessi pazienti all’inizio della terapia. Questi risultati suggeriscono che per proteggere il cervello del depresso è necessario un tempestivo trattamento che preveda dosaggi adeguati e tempi che vadano decisamente oltre la semplice remissione dei sintomi. In conclusione, la più recente ricerca neurobiologica dimostra il ruolo cruciale di una ridotta plasticità neuronale nell’eziologia della patologia depressiva, e suggerisce che una terapia farmacologica, soprattutto se combinata con un valido supporto psicosociale o psicoeducativo, possa garantire una migliore aderenza del paziente al trattamento. Infatti, la terapia farmacologica non può che trarre vantaggio dall’associazione con pratiche non farmacologiche capaci di favorire meccanismi che modulano il trofismo e la plasticità cerebrale. Figura: Ipotetiche modificazioni del trofismo neuronale e delle arborizzazioni dendritiche associate a stress cronico, trattamento con antidepressivi e sospensione precoce della terapia. AD = antidepressivo.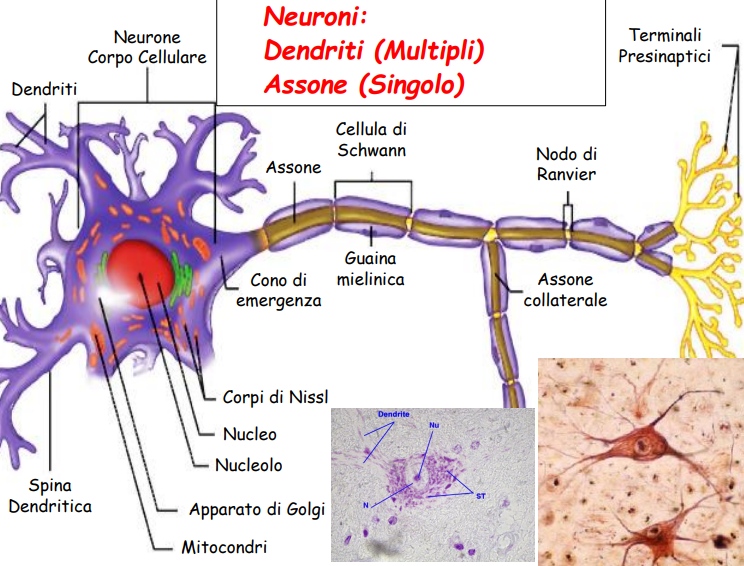
Gli= Le cellule della glia, dette anche cellule gliali, sono cellule che,
insieme ai neuroni e ai vasi sanguigni, formano il sistema
nervoso. Hanno funzione nutritiva e di sostegno per i neuroni,
assicurano l'isolamento dei tessuti nervosi e la protezione da corpi estranei
in caso di lesioni.
In conclusione, consolidate evidenze neurobiologiche dimostrano
che i neuroni del soggetto depresso presentano una perdita di trofismo e
plasticità neuronale che ne limitano il migliore adattamento agli stimoli
ambientali negativi. Le stesse evidenze dimostrano come gli antidepressivi
attivano, anche se con meccanismi aspecifici, la funzione di geni coinvolti
nella sintesi dei fattori trofici. L’efficacia clinica del trattamento con
antidepressivi è associata alla capacità di questa classe di farmaci di
ripristinare e mantenere nel tempo le proprietà plastiche del neurone.
L’evidenza che la sintesi di
fattori trofici e l’attivazione di meccanismi epigenetici ad essa associati
viene stimolata anche dall’esposizione ad un ambiente positivo, dall’attività
fisica, dalla corretta alimentazione e da altre buone abitudini di vita,
suggeriscono che nel trattamento della depressione l’efficacia della
imprescindibile terapia farmacologica può essere potenziata con l’ausilio di un
valido supporto psicosociale e psicoeducativo, e con l’impiego concomitante di
pratiche non farmacologiche capaci di favorire meccanismi trofici e la
plasticità cerebrale, ovvero la psicoterapia.